提起金屬相對原子質量越大產生,大家都知道,有人問初中化學置換反應相對原子質量與生成體積的關係,另外,還有人想問為什麼相對原子質量越大,生成質量越少,別說摩爾电子,我們還沒,你知道這是怎麼回事?其實氫的相對原子質量是多少,下面就一起來看看為什麼置換反應中,生成的越多,相對原子質量越小?希望能夠幫助到大家!
金屬相對原子質量越大產生
生成1g所需金屬質量為(相對原子質量/化合價)g
質量相同的2價金屬與足量的酸反應,產生的質量為(2m/相對原子質量)g,所以相對原子質量越小產生的越多.
Zn+2HCl===ZnCl2+H2↑
mx=2m/65
Mg+2HCl===MgCl2+H2↑
my=2m/24
的相對原子質量是多少
2氫原子是1
根據周期表可知:氫原子的相對原子質量為1
根據周期表可知:氫原子的相對原子質量為1
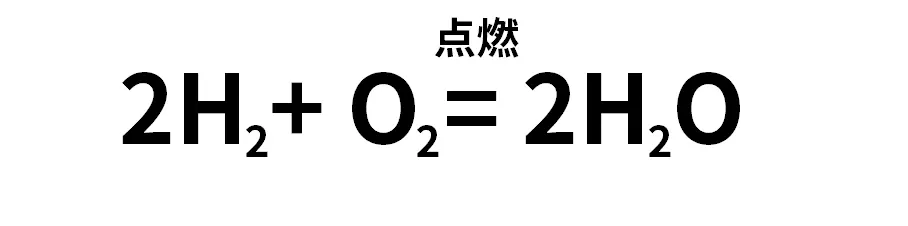
金屬相對原子質量越大產生:初中化學置換反應相對原子質量與生成體積的關係
相同質量的鐵與鎂與足量反應鎂生成多
相同大小的鐵與鎂與足量反應生成一樣多
主要看化合價和相對原子質量
鐵和鎂都是+2價,而相等質量的鎂比相同質量的鐵更多,所以相同質量的鐵與鎂與足量反應鎂生成多;當它們相同大小時生成一樣多
金屬產生的質量與原子相對原子質量有什麼關係
質量除以相對分子質量是得到的:摩爾數。
相對分子質量是相對原子質量的加和。
反應生成的多少為什麼可以判斷相對原子質量?好吧···我是初三學生、想提前預習下、可是不懂
(1)M+nHCl=MCln+n/2H2
n可以取1、2、3等
以n=2時為例:設M的相對原子質量為x
M+2HCl=MCl2+
x/=2/1gx=24
(2),其中M為m%,a中M與N原子個數比為1:1.5
b中含M為n%m%小於n%,說明b中M更多,M與N原子個數比大於1:1.5
所以答案不應為MN2,而應為3:4或1:1等(如:FeO)

為什麼相對原子質量越大,生成質量越少,別說摩爾电子,我們還沒
拿鐵和鋅為例,56份的鐵置換出2份.65份的鋅置換出2份.那麼,如果置換出的質量都為2g,那需鐵,而鋅要,所以同質量的金屬,當然鐵可以置換出多的.
根據產生的質量多少判斷金屬相對原子質量大小
在相同質量的不同金屬的情況下,與足量的或者稀反應,你的說法是正確的
相對原子質量
科普中國·科學:相對原子質量表
完全反應生成的多,相對原子質量就一定小···成立嗎?
不成立。
對於生成的量,除了相對原子質量之外還有一個影響因素。
下面是牛人總結的經驗:
氫的相對原子質量是多少
金屬與足量的稀或稀反應,
生成的質量所用金屬的相對原子質量成反比,與
該金屬元素的化合價成正比。
也可以用公式表示出來:
生成的質量=am/b
(其中,m是金屬的質量,a為該金屬元素的化合價,b為該金屬的相對原子質量)
比如說,質量為m的金屬鐵放入足量稀(或稀)中,生成的質量為2m/56,
質量為m的金屬鋁放入足量稀(或稀)中,生成的質量則為3m/27。
有點繞,不知道能不能看明白,
可以作為初三化學做題的技巧,希望能夠幫到你!
等質量的金屬與等質量、等濃度的酸反應
哪一種情況下不同金屬生成一樣多。
若金屬過量,酸不足,則計算時以酸的質量計算,產生的質量相同
哪一種相對原子質量小的多?
若金屬不足,酸過量,則計算時以金屬的質量計算,產生的質量不同,如果金屬都是相同價態,如+2價,則相對原子質量小的產生氣體多
希望對你有所幫助,滿意請採納,親!
你說的是不是等質量的金屬完全反應生成的?如果是那當然不成立。
比如說Mg和Al,Mg的相對原子質量約為24,Al的相對原子質量約為27。
如果兩者各取1g
Mg+2HCl=MgCl2+H2
n(H2)=1/
Al+3HCl=AlCl3+3/2H2
n(H2)=1/27/23=1/18
mol>1/
由此可見相對原子質量比較大的Al產生的H2反而比較多,所以不成立。
如果你指的是金屬與酸反應,且酸足量還要看物質的化合價
相對原子質量與化合價之比越小,生成越多
如Al和Mg相比較,Mg相對原子質量小,但生成少
以上就是與為什麼置換反應中,生成的越多,相對原子質量越小?相關內容,是關於初中化學置換反應相對原子質量與生成體積的關係的分享。看完金屬相對原子質量越大產生后,希望這對大家有所幫助!